生物学
2021.06.28
よく似たタンパク質を見分ける仕組みを発見! ~「概日時計」の分子メカニズムの解明に更なる前進~
国立大学法人東海国立大学機構 名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM※)の廣田 毅 特任准教授とサイモン ミラー 研究員は、ITbMのフロハンス タマ 教授とアシュトシュ スリバスタバ 研究員との共同研究で、「概日時計」を構成する非常によく似たタンパク質の間で、化合物を見分ける仕組みを明らかにしました。
細胞には1日周期のリズムを支配する概日時計があり、それを構成する時計タンパク質注1)「CRY1」と「CRY2」の役割の違いを明らかにするには、これらを見分ける化合物が必要です。しかし、両者はアミノ酸配列がよく似ているため、どちらか片方を見分ける化合物を作り出すのは困難でした。
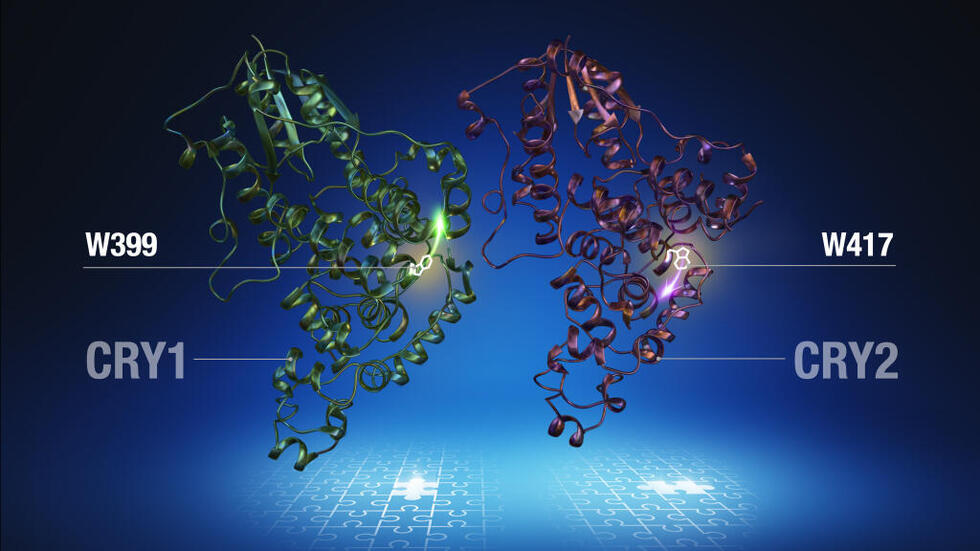
本研究では、この2つのタンパク質の結晶構造を解析し、両者の間では化合物に作用する部位のアミノ酸配列が同じであるにもかかわらず、その向きが異なることを発見しました。さらに、この向きを逆方向に人為的操作したところ、両者は逆の化合物を選択することがわかりました。
今後、このよく似たタンパク質を見分ける仕組みをもとに、概日時計の分子メカニズムの解明がさらに進むと期待されます。また、本研究により、よく似たタンパク質の働きを操作する化合物の開発が期待されます。
本研究成果は、2021年6月22日午前4時(日本時間)付米国科学誌「Proceedings of the National Academy of Sciences」に掲載されました。
・時計タンパク質の「CRY1」と「CRY2」の結晶構造を決定し、両者の違いを明らかにした。
・「ゲートキーパー」と名付けたアミノ酸の向きおよび「lid loop」注2)領域との相互作用がCRY1とCRY2で異なり、化合物の選択性に関与すると考えられる。
・ゲートキーパーとlid loopの相互作用を変化させると、化合物の選択性が逆転した。
・配列が同じでも、向きの違いによって選択性が生み出されることを見出した。
◆詳細(プレスリリース本文)はこちら
注1)時計タンパク質:
概日時計が働くために必要な遺伝子とタンパク質。哺乳類においてはCRY1、CRY2、PER1、PER2、CLOCK、BMAL1の6種類が知られている。これらの遺伝子やタンパク質の機能制御が概日時計の働きに重要な役割を果たすと考えられている。
注2)lid loop:
CRYタンパク質の一部の名称。化合物が結合するポケットの近傍に存在する。
雑誌名:Proceedings of the National Academy of Sciences
論文タイトル:Structural differences in the FAD-binding pockets and lid loops of mammalian CRY1 and CRY2 for isoform-selective regulation
著者:Simon Miller, Ashutosh Srivastava, Yoshiko Nagai, Yoshiki Aikawa,
Florence Tama, and Tsuyoshi Hirota
論文公開日: 2021年6月22日
DOI: 10.1073/pnas.2026191118
URL:https://www.pnas.org/content/118/26/e2026191118