工学
2021.04.26
細胞外小胞を簡便、迅速、高効率に分離・捕捉可能なナノ多孔質ガラスデバイスの開発に成功! ~細胞外小胞を利用した超早期がん診断に貢献~
国立大学法人東海国立大学機構 名古屋大学未来社会創造機構ナノライフシステム研究所/大学院工学研究科の湯川 博 特任准教授、馬場 嘉信 教授らは、AGC株式会社 材料融合研究所無機材料部ガラス・セラミックス材料チーム 山崎 秀司 研究員、東京医科大学医学総合研究所分子細胞治療研究部門 落谷 孝広 教授、熊本大学大学院生命科学研究部生体機能病態学分野消化器内科学講座 田中 靖人 教授らとの共同研究において、細胞外小胞※1を簡便、迅速、高効率に分離・精製可能なナノ多孔質ガラスデバイス※2の開発に成功しました。
あらゆる体液中に存在する細胞外小胞は、個々の細胞情報をマイクロRNA※3、タンパク質、糖鎖などの物質として蓄えており、これらを分離・回収して解析することで、数多の疾患の低侵襲かつ早期診断、特に、細胞外小胞を利用した早期がん診断法の確立が期待されています。しかし、細胞外小胞は100 nm程度と極めて小さく、また細胞外小胞を分離・回収する技術が乏しく、細胞外小胞による早期がん診断の発展・進展の障害となっていました。
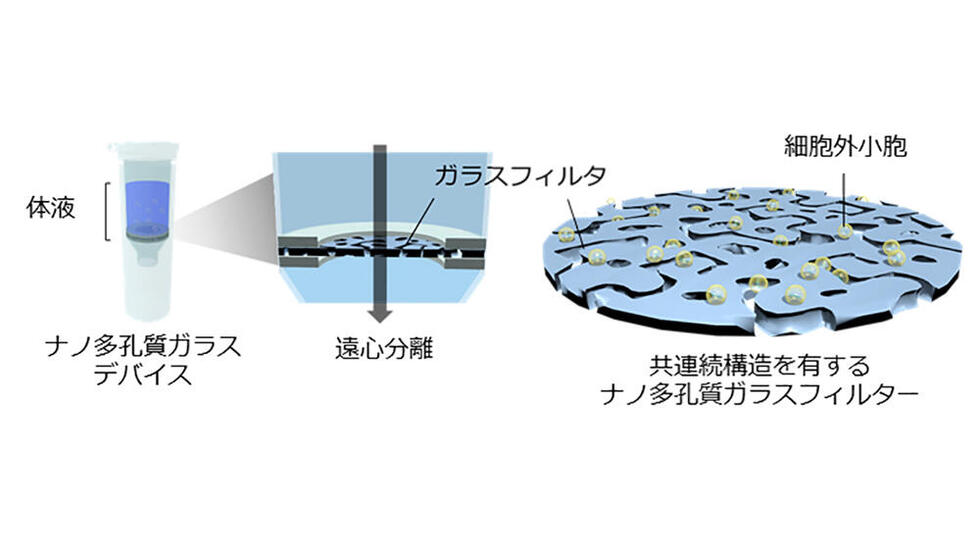
本研究では、SiO2, B2O3, Na2Oのスピノーダル分相※4を酸・アルカリ処理することで得られたSiO2から成る厚さ0.3 ~ 1.0 mm、孔径 150 ~ 600 nmに制御された共連続構造を有するナノ多孔質ガラスフィルターを作成し、これを遠心分離カラムに組み込んだナノ多孔質ガラスデバイスの開発に成功しました。
本デバイスを利用することで、細胞外小胞を簡便、迅速(5分以内)、且つ高効率に分離・捕捉できるようになり、更に、これまでの一般的な方法と比較しても有用であるため、臨床現場への普及により細胞外小胞を利用した超早期がん診断の実現への貢献が期待されます。
本研究成果は、国際科学誌「Scientific Reports」(英国時間2021年4月21日付)のオンライン版に公開されました。
なお、本研究は、国立研究開発法人 科学技術振興機構(JST) 革新的イノベーション創出プログラム(COI STREAM)、及び日本医療研究開発機構(AMED) 肝炎等克服実用化研究事業の支援を受けて実施されました。
・あらゆる体液中に存在する細胞外小胞は、個々の細胞情報をマイクロRNA、タンパク質、糖鎖などの物質として蓄えており、これらを分離・回収して解析することで、数多の疾患について、低侵襲に早期に診断できる。
・ 細胞外小胞は非常に小さいため(約100 nm)、現状、医師が臨床現場において、日常的に細胞外小胞を分離・回収する技術が乏しく、細胞外小胞を用いた診断の実現やその発展に大きな障害となっていた。
・厚さ0.3 ~ 1.0 mm、孔径 150 ~ 600 nmに制御されたガラスフィルターを有する、ナノ多孔質ガラスデバイスの開発に成功し、本デバイスにより、通常の遠心機を用いることで、細胞外小胞の簡便、迅速(5分以内)、且つ高効率な分離・捕捉に成功した。
・これまでの方法と比較しても有用であり、臨床現場への普及により細胞外小胞を利用した超早期がん診断の実現への貢献が期待される。
◆詳細(プレスリリース本文)はこちら
※1.細胞外小胞
細胞が分泌する直径40~5,000 nm程度の脂質2分子膜に覆われた小胞体。
※2.ナノ多孔質ガラスデバイス
多孔質とは細孔が非常に多く空いている材料のことを意味し、そのなかでも細孔の大きさがナノサイズのものがナノ多孔質(ポーラス)材料という。ナノ多孔質ガラスデバイスは、ナノ多孔質ガラス膜を膜状に成型し、遠心分離カラムに導入したもの。
※3.マイクロRNA
20~25塩基長の短いRNA鎖である機能性核酸。細胞内には多種類のマイクロRNAが存在し、主に、細胞外小胞に内包され、細胞外へ放出されることが知られている。
※4.スピノーダル分相
不安定状態から平衡状態への状態変化に対応する相分離のこと。
掲載誌名:Scientific Reports
論文タイトル:Co-continuous structural effect of size-controlled macro-porous glass membrane on extracellular vesicle collection for the analysis of miRNA
著者:Hiroshi Yukawa 1,2,3,4 *, Shuji Yamazaki 5, Keita Aoki 2, Kengo Muto 2, Naoto Kihara 5, Kazuhide Sato 1,4,6, Daisuke Onoshima 1, Takahiro Ochiya 7, Yasuhito Tanaka 8, and Yoshinobu Baba 1,2,3,9*
所属:1. Institute of Nano-Life-Systems, Institutes of Innovation for Future Society, Nagoya University, Furo-cho, Chikusa-ku, Nagoya 464-8603, Japan.
2. Department of Biomolecular Engineering, Graduate School of Engineering, Nagoya University, Furo-cho, Chikusa-ku, Nagoya 464-8603, Japan.
3. Institute of Quantum Life Science, National Institutes for Quantum and Radiological Science and Technology, Anagawa 4-9-1, Inage-ku, Chiba, 263-8555, Japan.
4. Nagoya University Institute for Advanced Research, Advanced Analytical and Diagnostic Imaging Center (AADIC) / Medical Engineering Unit (MEU), B3 Unit, Nagoya University, Tsurumai-cho 65, Showa-ku, Nagoya, 466-8550, Japan.
5. AGC Inc., 1-5-1, Marunouchi, Chiyoda-ku, Tokyo 100-8405, Japan.
6. Nagoya University Institute for Advanced Research, S-YLC, Furo-cho, Chikusa-ku, Nagoya 464-8603, Japan.
7. Department of Molecular and Cellular Medicine, Institute of Medical Science, Tokyo Medical University, Shinjuku, Shinjuku-ku, Tokyo 160-8402, Japan.
8. Department of Gastroenterology and Hepatology, Faculty of Life Sciences, Kumamoto University, Honjo 1-1-1, Chuo-ku, Kumamoto, 860-8556, Japan.
9. College of Pharmacy, Kaohsiung Medical University, Shin-Chuan 1st Rd., Kaohsiung, 807, Taiwan, R.O.C.
DOI: 10.1038/s41598-021-87986-2
URL: https://www.nature.com/articles/s41598-021-87986-2