医歯薬学
2025.09.10
TFIIH転写因子複合体の構造維持機構を解明 ~希少難病トリコチオジストロフィーの創薬開発へ応用~
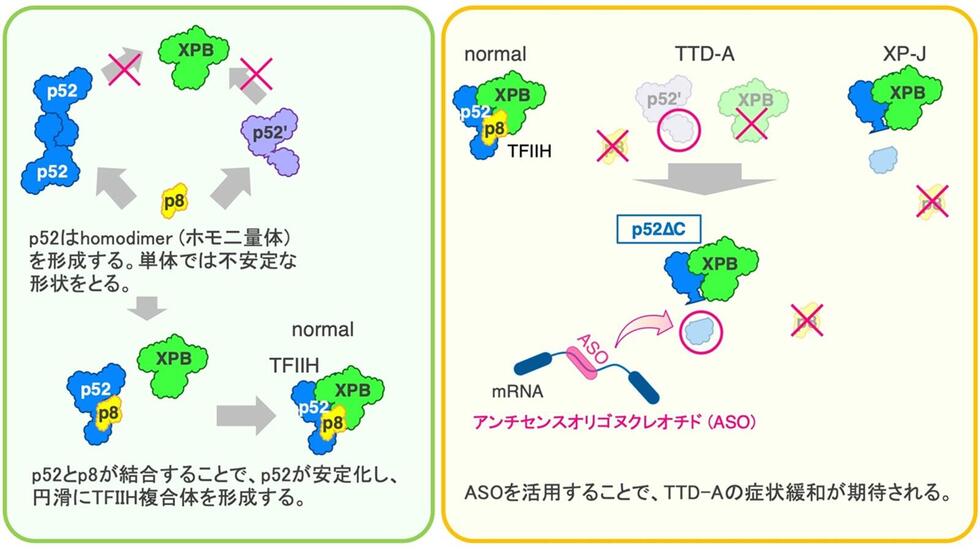
・mRNA合成とDNA修復に関与する基本転写因子IIH (TFIIH)のp52蛋白質をコードするGTF2H4/XPJ遺伝子の異常により、色素性乾皮症 (XP-J; 指定難病159)を発症することを明らかにした。
・p52蛋白質の機能解析から、TFIIH複合体の構造を安定に維持するメカニズムを解明した。
・TFIIHを安定に維持するメカニズムから、超希少疾患の1つであるトリコチオジストロフィー (TTD-硫黄欠乏性毛髪発育異常症)の病態緩和につながる核酸創薬のストラテジーを提示した。
名古屋大学大学院医学系研究科附属神経疾患・腫瘍分子医学研究センター 分子遺伝学の中沢 由華 教授、葉 琳 大学院生、環境医学研究所 発生遺伝分野/難病ゲノム解析センターの岡 泰由 講師、荻 朋男 教授らの研究グループは、Rare Disease UK (英国)との共同研究で、基本転写因子IIH複合体 (transcription factor II H: TFIIH)の新たな構造維持メカニズムを明らかにしました。
ヌクレオチド除去修復機構 (nucleotide excision repair: NER)に関与するTFIIH複合体 (基本転写因子複合体)の構成因子の1つであるp52をコードするGTF2H4/XPJ遺伝子の異常により、色素性乾皮症 (xeroderma pigmentosum: XP; 指定難病159)を発症することが明らかとなりました。一方で、別のTFIIH複合体構成因子のp8が先天的に欠損すると、ゲノム不安定性疾患の1つである超希少難病 (N-of-1疾患)のトリコチオジストロフィー (TTD-硫黄欠乏性毛髪発育異常症)を発症することが知られています。このXPとTTDの病態を分けているメカニズムを探るため、p52因子の機能解析およびp8因子との関係性を調査しました。その結果、TFIIH複合体の構造を安定に維持するメカニズムが明らかになりました。またこれらの結果をもとに、TTD患者の病態緩和につながるアンチセンス核酸薬を開発しました。本研究の成果は、NER メカニズムとTFIIH複合体形成の新たなモデルを提示しただけでなく、今後更なる検討を重ねることで、TTDの創薬開発にも貢献してゆくと期待されます。
本研究成果は、2025年9月9日12:00 PM EDT(日本時間9月10日01:00 AM)に国際学術誌『Journal of Clinical Investigation (JCI)』のオンライン版に掲載されました。また、2025年10月発行の印刷版に掲載予定です。
◆詳細(プレスリリース本文)はこちら
◆詳細(プレスリリース英文)はこちら
雑誌名:Journal of Clinical Investigation
論文タイトル:TFIIH-p52∆C defines a ninth xeroderma pigmentosum complementation-group XP-J and restores TFIIH stability to p8-defective trichothiodystrophy
著者:Yuka Nakazawa (名大分子遺伝), Ye Lin (名大分子遺伝), Yasuyoshi Oka (名大環研), Hironobu Morinaga (名大環研), Kana Kato (名大環研/難病ゲノムセンター), Mayuko Shimada (名大環研/難病ゲノムセンター), Kotaro Tsukada (名大環研), Koyo Tsujikawa (名大環研/難病ゲノムセンター), Yosuke Nishio (名大環研/難病ゲノムセンター), Hiva Fassihi, Shehla Mohammed, Alan Lehmann, Tomoo Ogi (名大環研/難病ゲノムセンター)
DOI: 10.1172/JCI195732